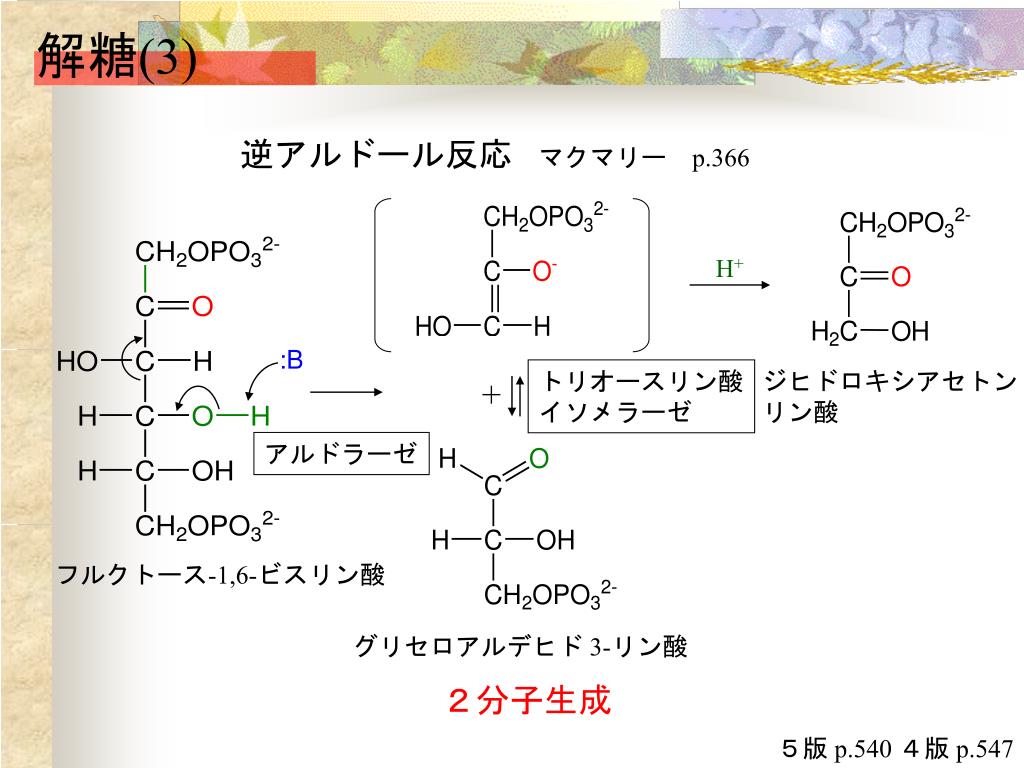
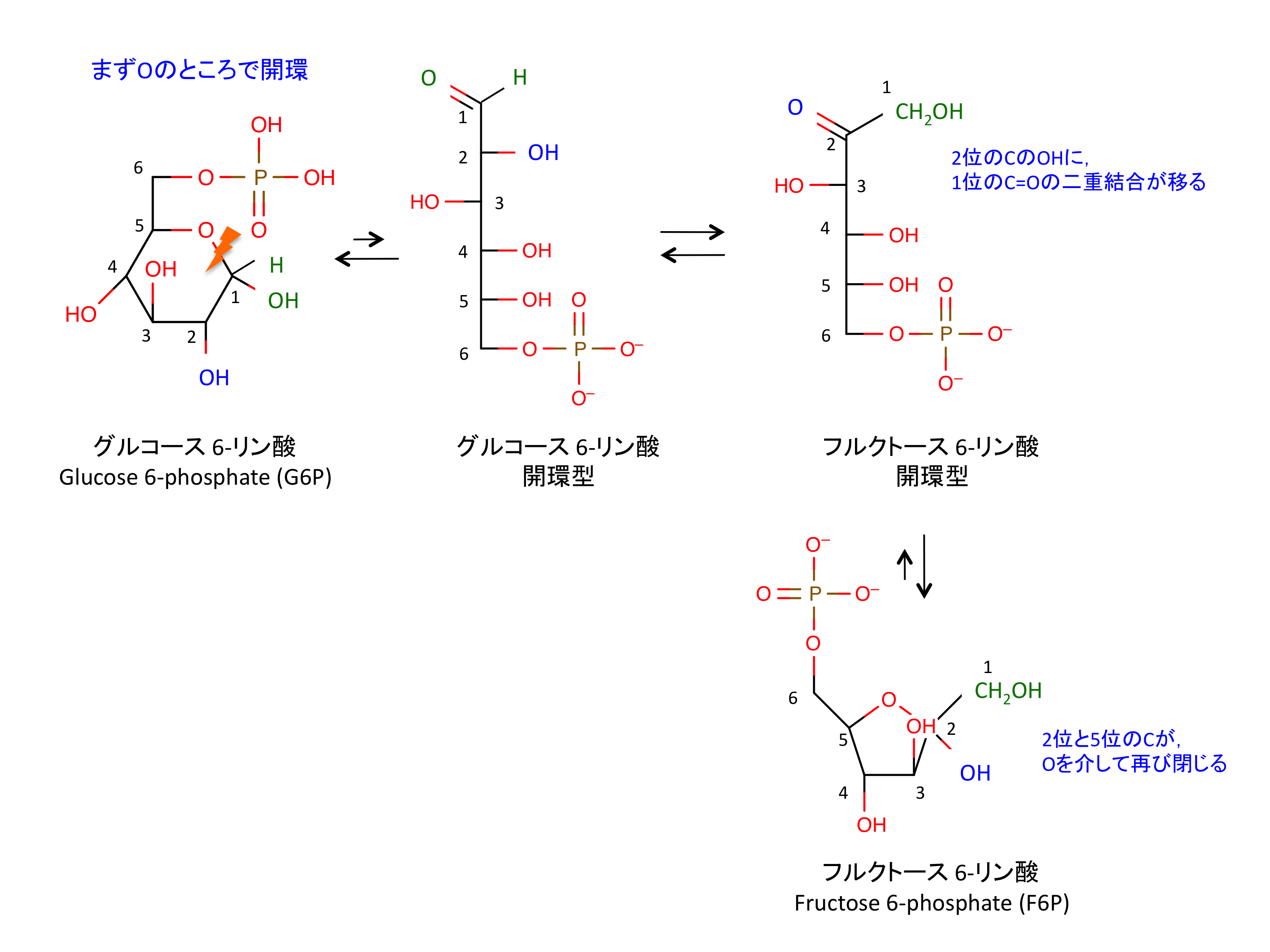
フルクトース-1,6-ビスホスファターゼ(Fructose 1,6-bisphosphatase、FBPアーゼ、EC 3.1.3.11)は、同化過程の糖新生やカルビン回路でフルクトース-1,6-ビスリン酸をフルクトース-6-リン酸に変換する酵素である。FBPアーゼの触媒する反応は、解糖系におけるホスホフルクトキナーゼの逆反応である。これらの酵素はどちらも一方向しか触媒できず、フルクトース-2,6-ビスリン酸等の代謝産物によって制御されるため、どちらか一方の活性が高くなると、もう一方の活性が低くなる。つまり、フルクトース-2,6-ビスリン酸はFBPアーゼをアロステリック阻害するが、ホスホフルクトキナーゼ-Iを活性化させる。フルクトース-1,6-ビスリン酸は多くの異なる代謝経路に関与し、ほぼ全ての生物で見られる。FBPアーゼは、触媒に金属イオン(Mg2 とMn2 )を必要とし、Li2 に強く阻害される。
ブタのFBPアーゼのフォールディングは、イノシトール-1-ホスファターゼと相同である。イノシトールポリリン酸-1-ホスファターゼ、イノシトール-1-ホスファターゼ、FBPアーゼは、金属イオンに結合し触媒作用に関与していることが示されているAsp-Pro-Ile/Leu-Asp-Gly/Ser-Thr/Serのモチーフ配列を共有している。このモチーフは、菌類、細菌、酵母のイノシトール-1-ホスファターゼでも保存されている。これらのタンパク質は、イノシトールシグナル、糖新生、硫酸塩同化、そして恐らくキノン代謝等の様々な代謝経路に関与する。
3つの異なる種類のFBPアーゼのグループ(FBPアーゼI,II,III)が真核生物及び細菌で同定されている。最近まで古細菌では発見されていなかったが、イノシトールモノホスファターゼの活性も持つ4つめの新しいグループのFBPアーゼ(FBPアーゼIV)が最近になって同定された。
また、好熱性古細菌や超好熱性細菌Aquifex aeolicusでは、新しいグループのFBPアーゼ(FBPアーゼV)が発見された。このグループのFBPアーゼは基質特異性が高く、これらの生物の真のFBPアーゼであることが示唆されている。二次構造の研究により、FBPアーゼVは、通常の糖ホスファターゼが持つα-β-α-β-αの5層のサンドイッチ構造ではなく、新しいフォールディングであるα-β-β-αの4層構造を持っていることが明らかとなった。触媒部位の側鎖と金属リガンドの配列は、他のFBPアーゼの機構として提案されていた3つの金属イオンによる触媒機構と一致することが発見された。
低GC含量のグラム陽性細菌であるフィルミクテス門の持つFBPアーゼは、他の生物の持つFBPアーゼと配列上の類似性がほとんどない。枯草菌の酵素はアデノシン一リン酸で阻害されるが、ホスホエノールピルビン酸によりこの阻害は解除され、またMn2 イオンに依存する。この酵素を欠く変異体は、リンゴ酸やグリセロールのような糖新生成長基質でも生きることができる。
関連項目
- フルクトース-1,6-ビスホスファターゼ欠損症
- フルクトース
- 糖新生
- 代謝
出典
関連文献
- Berg, Jeremy Mark; John L. Tymoczko, Lubert Stryer (2002). “Glycolysis and Gluconeogenesis”. In Susan Moran (ed.). Biochemistry (5th Edition ed.). 41 Madison Avenue, New York, New York: W. H. Freeman and Company. ISBN 0-7167-3051-0. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Search&db=books&doptcmdl=GenBookHL&term=fructose bisphosphatase AND stryer[book] AND 216199[uid]&rid=stryer.section.2281#2284
外部リンク
- Fructose-1,6-Biphosphatase - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)