銅含有亜硝酸還元酵素(どうがんゆうあしょうさんかんげんこうそ、英語: Copper-containing Nitrite Reductase)は補因子として銅イオンを含む 異化型の亜硝酸還元酵素で、亜硝酸イオン(NO2-)を一酸化窒素(NO)へと一電子還元する反応を触媒する酵素である。Copper-containing Nitrite Reductaseを略してCuNIR(カッパ―エヌアイアール)と呼ばれることが多い。本酵素の構造遺伝子であるnirKは水中や土壌中の窒素酸化物を分子状窒素(N2)へと段階的に還元する脱窒に関わる古細菌、真正細菌および一部の菌類に広く存在する。脱窒自体は嫌気呼吸の1つであり、nirKを持つ生物の多くは通性嫌気性生物である。脱窒過程の最初の段階である硝酸塩の還元を触媒する硝酸塩還元酵素は多くの生物が有する酵素であるが、次の段階を触媒する異化型の亜硝酸還元酵素を持つ生物は限られており、酸素の少ない環境下では脱窒菌がエネルギー合成上有利なため、このような代謝系が進化してきたものと考えられている。
構造
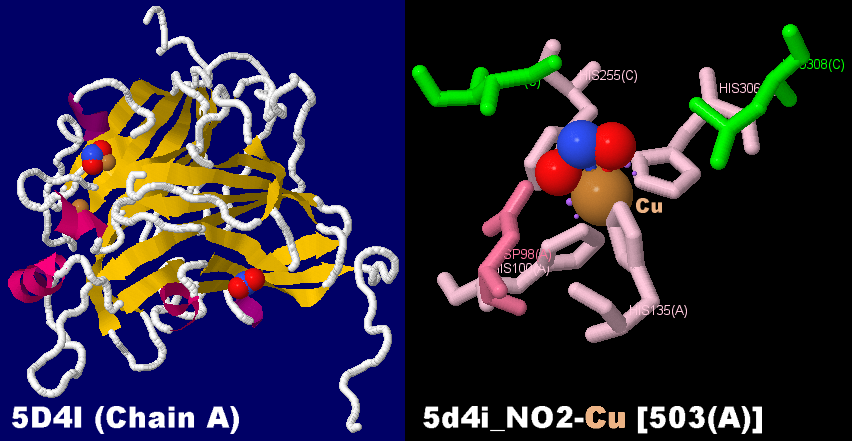
CuNIRはマルチ銅酸化還元酵素(マルチ銅タンパク質)の1種である。1991年に初めてAchromobacter cycloclastes由来のCuNIRの結晶構造が明らかになって以来、X線結晶構造解析やNMRを用いた解析で構造が知られているCuNIRの多くはホモ3量体構造を取り、各モノマーはグリークキーβバレル構造からなる2つのキュプレドキシンドメインによって構成される。メタノール資化性脱窒菌であるHyphomicrobium denitrificansから単離されたCuNIR(HdNIR)のモノマーは、N末端側にさらにもうひとつのキュプレドキシンドメインが付加した構造をしており、一般的なCuNIRのような3量体構造が2つ向き合った6量体構造を取ることが知られている。このようなドメイン付加型CuNIRは、他の生物にも広く分布していることがゲノム解析によって明らかになっている。例えば類鼻疽菌(Burkholderia pseudomallei)が有するnirK遺伝子は、C末端側にシトクロムcドメインが付加した構造であることが知られている。CuNIRの各モノマーには2つの銅イオンが含まれている。これらの銅イオンはその配位環境の違いから区別され、それぞれタイプ1銅、タイプ2銅と呼ばれている。
タイプ1銅
- 構造的・分光学的特徴
- タイプ1銅(Type 1 Cu, T1 Cu)は1つのシステインと2つのヒスチジンが平面3配位に近い形で配位し、さらに軸位の方向にメチオニンが4つ目のリガンドとして存在する。タイプ1銅は酸化状態(Cu2 )の紫外可視吸収スペクトルにおいて、システインのπ結合性のp軌道から銅のd軌道への電荷移動遷移(LMCT)に由来する強い吸収を600nm付近に持つため,その溶液は青色を呈し、別名ブルー銅とも呼ばれる。CuNIRの多くはさらに、システインのσ結合性のp軌道から銅のd軌道へのLMCTに由来する吸収も450nm付近に持つため、緑色から青緑色を呈する。タイプ1銅は還元状態(Cu )ではLMCTが起こらず、溶液は無色になる。また、酸化状態でEPR活性であるが、不対電子がシステイン上に非局在化する傾向が強いため、銅の電子と核スピンの相互作用が弱められ、EPRによって測定される超微細結合定数は5-7mT程度と小さい。
- 機能
- タイプ1銅はアズリンやシュードアズリンなどのブルー銅タンパク質や、シトクロムc551のようなc型ヘムタンパク質といった生理的電子供与体から電子を受け取る場であると考えられている。タイプ1銅のリガンドであるシステインと、タイプ2銅のリガンドの3つのヒスチジンの1つはアミノ酸配列上隣同士であり、タイプ1銅が受け取った電子はペプチド結合を含む11の共有結合を通して12~13Å離れたタイプ2銅へ伝達されると言われている。
タイプ2銅
- 構造的・分光学的特徴
- タイプ2銅はサブユニット間に存在する。CuNIR表面からは約8Åの深さに位置し、3つのヒスチジンが配位している。このうち2つのヒスチジンはタイプ1銅のリガンドと同じモノマー内の残基であるが、残りの1つは隣のサブユニットに存在するヒスチジンである。酵素反応が行われないときはさらに軸位から水、または水酸化物イオンが配位しており、全体としてはゆがんだ四面体型構造をとっている。タイプ2銅はタイプ1銅と異なり、紫外可視吸収スペクトルにおいて明瞭な吸収帯を持たないが、酸化状態でEPR活性であり、タイプ1銅よりも大きな超微細結合定数(10-20mT)を持つ。
- 機能
- タイプ2銅は、タイプ1銅から伝達された電子を用いて亜硝酸イオンの還元反応が行われる活性中心である。亜硝酸還元反応の際には亜硝酸イオンが軸位に配位している水分子と入れ替わって銅に配位するとされている。活性中心構造が類似したスーパーオキシドディスムターゼ(SOD)活性も持つとされるがその活性能は低い(SODの半分程度)。
推定されている反応メカニズム
CuNIRが触媒する反応の化学反応式は以下のとおりであり、1つの電子と2つのプロトンが消費され、NO分子と2分子の水が生成する。
タイプ2銅に配位している水分子が基質である亜硝酸イオン(プロトン化された亜硝酸イオンと言われている)と入れ替わり、2つの酸素で配位する(窒素も配位結合距離にある構造も知られている)。2つの酸素と銅との間の配位結合距離はほぼ等しい。タイプ2銅上部にあるアスパラギン酸が、配位した亜硝酸イオンの酸素原子と水素結合をつくり、この水素が反応に使われる1つ目のプロトン源であると言われている。もう1つのプロトンは、やはりタイプ2銅上部に位置するヒスチジンが関わる水素結合ネットワークであるとされている。DFT計算を用いた研究によれば、2つ目のプロトンが供給された時点で自発的に片方のNO結合が開裂し、NOと水が生成するとされる。生成物であるNO結合型CuNIRのX線結晶構造解析から、NOは銅に対して、モデル錯体でよく見られるようなエンドオンではなくサイドオンで結合しているとされる。
分光学的・結晶構造学的研究によれば、「亜硝酸イオンが銅に配位するとタイプ1銅からタイプ2銅への分子内電子移動が促進されること」、「タイプ2銅が還元状態の時はタイプ1銅からの電子移動が起こらないこと」が示唆されるため、亜硝酸還元反応においては基質の配位と分子内電子移動がこの順に秩序だって起こるとされるが(ordered mechanism)、基質の配位より先に分子内電子移動が起こることも可能であるとする研究もあり、すなわち2つのルートが組み合わさって反応が起こる(random sequential mechanism)のだとも言われている。近年になって、この分子内電子移動はプロトン移動とカップルして起こることが示唆されている。
また、タイプ2銅上部に存在するイソロイシンは多くのCuNIRで保存されており、基質の配向を制御する働きをしていると言われている。
分類と進化
かつては溶液が緑色を呈するCuNIRをgreen NIR、青色を呈するCuNIRをblue NIRとして分類していたが、green NIRとblue NIRの間には大きな構造的違いは見られない。淋菌(Neisseria gonorrhoeae)が有するCuNIRホモログであるAniA(アニエー、アニア)の結晶構造解析によって既知のCuNIRと異なる構造のCuNIRが認知されて以来、CuNIRはクラス I CuNIRとクラス II CuNIRに分類される。クラス I CuNIRはクラス II CuNIRに比べ、タワーループと呼ばれるループおよび、2つのキュプレドキシンドメインを繋ぐリンカーループが長いという特徴がある。また、上述のHdNIRのようにさらに別のドメインが付加したCuNIRをクラス III CuNIRと呼ぶ場合もある。
CuNIRを含むマルチ銅酸化酵素の進化的起源についてはいくつかの研究があり、提唱されている説によればCuNIRは、ゲノム上の1つのブルー銅タンパク質の構造遺伝子に遺伝子重複が生じ、連続する2つのキュプレドキシンドメインを持ったタンパク質が生まれ、これが3量体を形成するようになり、それと前後して2つのうち片方のキュプレドキシンドメインのタイプ1銅サイトが消失し、新たにサブユニット間にタイプ2銅サイトが形成されるように進化したと考えられている。
脚注